レニン阻害剤
高血圧は、心筋梗塞、脳梗塞はじめ致命的な疾病の原因になります。
血圧上昇の機構は複雑ですが、その原因の一つにレニンーアンジオテンシン-アルドステロン系があります。
血中に存在するアンジオテンシノーゲンは、腎臓で合成されたレニンという酵素によってN末端から10番目のロイシンと11番目のバリンの間で加水分解が起き、アンジオテンシンIと呼ばれるデカペプチドを放出します。
アンジオテンシンIに重要な生理活性は見られませんが、アンジオテンシン変換酵素(ACE)によって、さらにC側から二つのペプチドが切り離され、アンジオテンシンIIが生成します。
アンジオテンシンIIはアルドステロンの生合成を加速し、アルドステロンは腎臓でナトリウムイオンの再吸収を促進する効果があるため、同時に水分も吸収され、体液(血液)量が増加、即ち血圧が増加します。
アンジオテンシンIIは、N側アスパラ銀酸がさらに加水分解されてアンジオテンシンIIIに、さらにN側アルギニンが加水分解をうけてアンジオテンシンIVに変換されます。
アンジオテンシンIII、IVも血圧上昇効果をしましますが、もっとも強いのはアンジオテンシンIIだそうです。
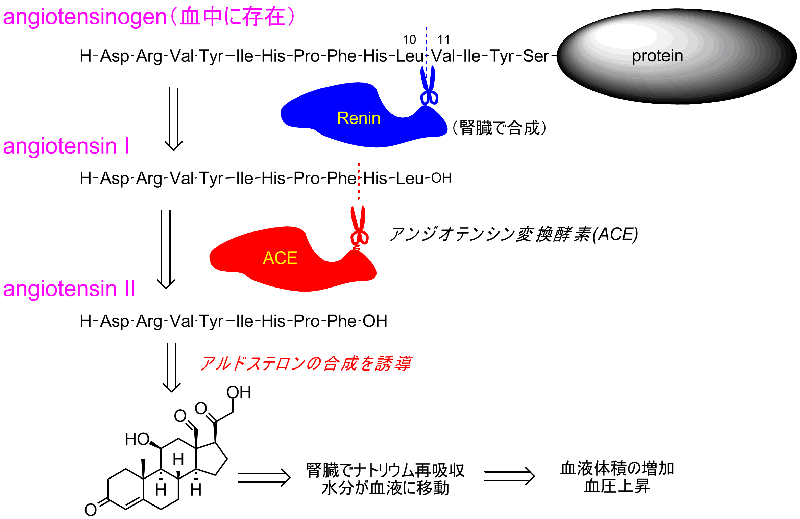
下にプロテインデータバンクに登録されているアンジオテンシノーゲンの構造を示しました。
青色で示された部分がレニンによって切り出されてアンジオテンシンIになるデカペプチド部分です。
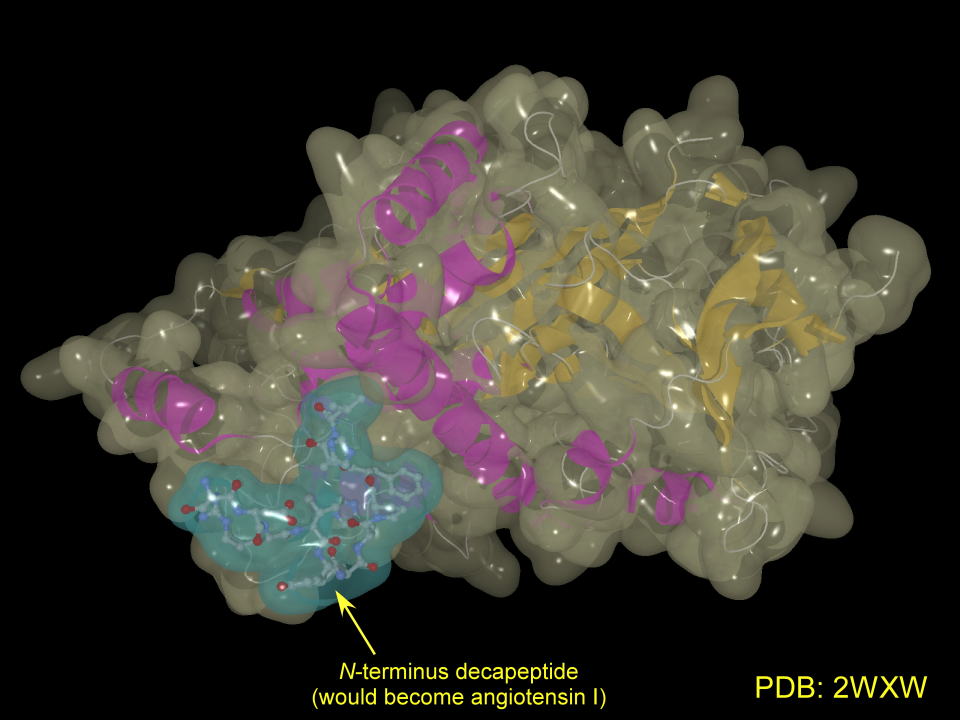
左ボタンを押してドラッグすると分子を動かすことができます。N末端の11残基をボールアンドスティックモデルで表現しています。
(MolFeatプラグインが必要です。)
レニンーアンジオテンシン-アルドステロン系をストップさせれば血圧上昇に歯止めをかけられるはずです。
やり方は二つ、
① レニンを阻害する。
② アンジオテンシン変換酵素(ACE)を阻害する。
考えられます。
研究はレニン阻害が先行して展開されました。
理由は、当時レニンのX線結晶解析はすでに行われており、その構造を基に阻害剤の設計を行うことが可能であったのに対し、ACEの結晶化はできておらず、同様な情報を得ることができなかったためです。
高血圧の薬は、仮に単価が低くても、患者数がとてつもなく多いこと、また高血圧症の完治は難しいので、患者は死ぬまで毎日飲んでくれる、非常に市場価値の高いものです。
レニン阻害剤ではないものの、抗高脂結晶薬のアルガトロバンは、年間一兆円を超える売り上げだそうです。(No2の薬剤の二倍の売り上げです。)
1980年代後半から、多くの薬品会社がレニン阻害剤の開発を行い、数多くの阻害剤の開発がおこなわれました。
この開発ではコンピュータモデリングという手法が導入され、タンパクの三次元構造と電荷分布などコンピュータで解析して薬剤のデザインが行われました。
いわゆるin silico研究の草分け的薬剤ともいえます。
下にプロテインデータバンクに登録されているレニンの構造を示しました。
中央上部の空間に基質であるアンジオテンシノーゲンN末端を取り込み切断します。
ペプチドが挿入される部位(反応部位、認識部位)はセリン、スレオニン、アスパラギン酸など負に帯電しやすいアミノ酸が配置されています。
これの静電硬効果によって基質を吸い寄せるのだと思います。
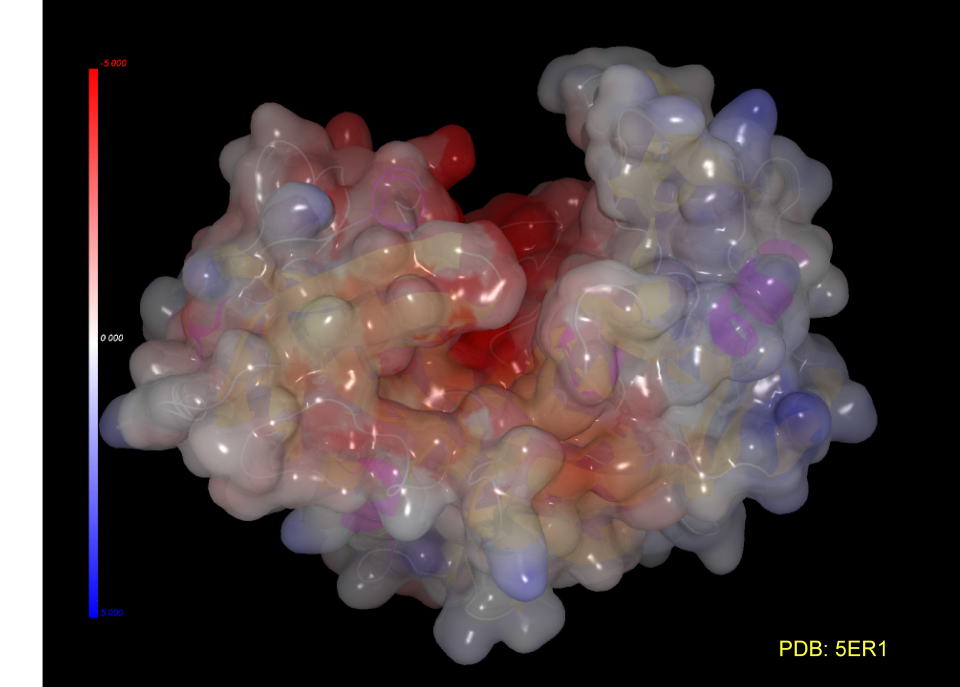
この結晶には基質アナログが挿入されています。(阻害剤が入った方がタンパクの構造が安定し、結晶化しやすい場合も多いそうです。)
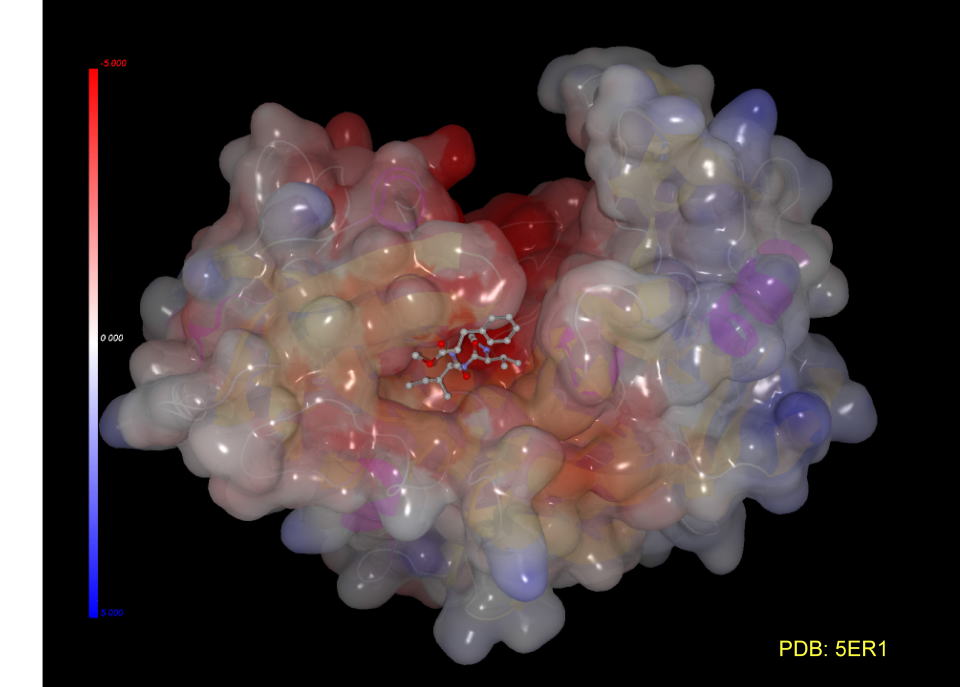
阻害剤をC空間充填モデルで表現すると隙間なく挿入されていることが判ります。
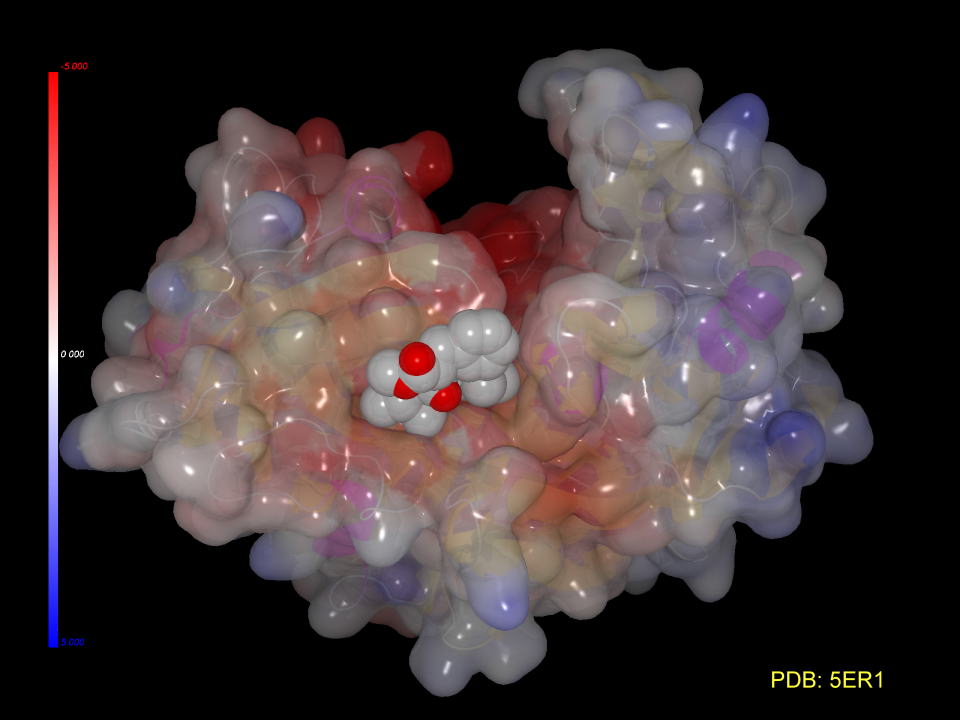
3D図を示しました。(MolFeatプラグインが必要です)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ、左ボタン長押しで現れたメニューから自動回転を選択すると回転を続けます。右クリックでSceneを変えると表現方法が変わります。)
CH-66という薬剤はアンジオテンシノーゲンのN末端から4番目から16番目のペプチドを模様し、切断される部位を中央において設計されています。
これとレニンとの複合体を観察すると、アンジオテンシノーゲンが分解するとき図では赤く負に荷電しているところ全体でペプチドを引き寄せている様子が想像できます。
3Dで見るとより分かりやすいと思います。(MolFeatプラグインが必要です。)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ、左ボタン長押しで現れたメニューから自動回転を選択すると回転を続けます。右クリックでSceneを変えると表現方法が変わります。)
阻害剤CH-66の構造を抽出しました。レニンの反応部位にあたる場所は、ペプチド構造から変換して、酵素によって分解されないように工夫してあります。

3D図はこちらです。(MolFeatプラグインが必要です)
レニンに限らず反応部位に結合する阻害剤は 本来の基質以上の強さでしっかりと結合する必要があります。
結合力は圧倒的に強い必要があります。弱いと、体内で遊離の阻害剤が存在することになり、非特異結合でたとえば別のぺプチダーゼと結合してしまえば副作用をもたらします。
また結合後に酵素反応が進行しないように構造を天然型から変更しておくいつようがあります。
さらに、経口投与とする場合、消化器で分解してはいけません。さらに、腸での吸収など、難しい問題は山ほどあります。
各社、試験管の中ではレニンを効果的に阻害しましたが、腸からの吸収などコンピュータモデリングでは予想できない問題にぶつかり、多くの多くの薬剤の開発は途中でストップしてしまいました。
高血圧の薬は経口投与が重要です。毎日お医者さんで降圧剤を注射してもらっていては、会社をクビになってしまいます。(人間的生活という視点からという意味です。QOLといいます。)
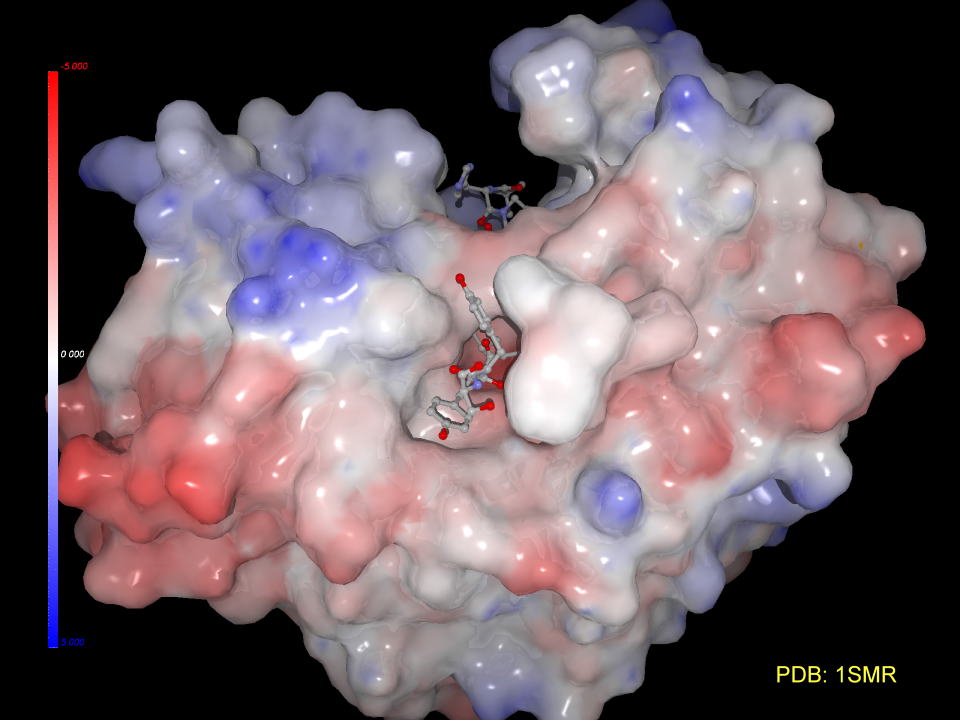
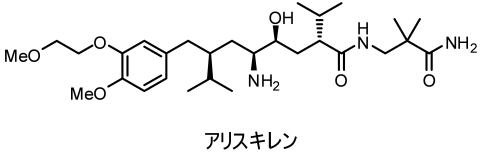
2008年3月にこれまでの問題を解決した直接的レニン阻害剤がノバルティス社よりアリスキレン(商品名ラジレス)が申請されました。
経口投与です。ぺプチダーゼにより分解しないようにαアミノ酸構造は無くしてあります。。
下の図はアリスキレンとレニンとの複合体を示したものです。見やすくするためにタンパク質表面を削ってあります。
ベンゼン環に結合したメトキシプロピルオキシ基は見事にレニンのポケット奥深くまで侵入、錨をおろしています。

3D図を示しました。(MolFeatプラグインが必要です。)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ、左ボタン長押しで現れたメニューから自動回転を選択すると回転を続けます。右クリックでSceneを変えると表現方法が変わります。)








